
2.2 定位效应和反应活性
在芳香族化合物发生取代反应时,环上的取代基对取代反应发生的位置和反应进行的速度,都有一定的影响。前一种影响叫取代基的定位效应;后一种影响致使反应进行的比母体芳香环的反应速度大的,叫致活作用;致使反应进行的比母体芳香环的反应速度小的,叫致钝作用。
2.2.1 一元取代苯中的反应活性和定位效应
当亲电取代反应发生在一基取代的苯上时,新基团可能被导入邻、间或对位,取代比用苯或许更快或许更慢。增大反应速度的基团叫活化基团,使反应速度减慢的基团叫钝化基团。某些基团主要是间位的,这些基团全是钝化的;其余主要是邻对位的,这些基团的某些也是钝化的,但大多数是活化的。各个基团的定位效应和反应活性,可以根据共振效应和场效应对中间体芳烃正离子的稳定性来作出解释。
根据以上理论,可以把基团分为三类:
(1)与环相连的碳原子上,有未共享电子对的基团。属于此类的有:O-,NR2,NHR,NH2,OH,OR,NHCOR,OCOR,SR和四种卤素。这些基团是邻对位的。
(2)与环相连的原子上缺少未共享电子对的基团是-I的。属于此类的基团有:(按钝化能力减少排序)NR3+,NO2,CN,SO3H,CHO,COR,COOH,COOR,CONH2,CCl3,NH3+。这些基团是间位的。
(3)连到环的原子上缺未共享电子对又是邻对位的基团。属于此类的基团为:烷基,芳基和COO-基,这些都是活化苯环的,它们是邻对位的。
2.2.2 邻/对比率
当邻对位基团在芳环上时,到底形成多少邻位产物和多少对位产物,一般来说是非常难以确定的。它们之间的比例大都是由反应条件决定的,例如甲苯的氯化。影响邻/对比率的又一重要因素是位阻效应,如或环上基团或进攻基团很大,于是位阻抑制了邻位产物的形成,这样增大了对位产物的数量。
当邻对位基是带有未共享电子对的基时,还有一种以消耗邻位产物来增加对位产物的含量的效应。
在某些情况下,由于亲电试剂和指示基团之间的相互作用,因而邻/对比率很高。例如,甲基苯乙醚用五氧化二氮硝化时,邻/对比率要比用硝酸和硫酸更平常的混合酸硝化时更高。
还有,如果苯环上连接着一个场效应比较大的基团,由于场效应随着距离的加大而影响减小,因而在邻位的影响比在对位的大。在卤素中,氟的-I效应最强,因而和对位相比,氟在邻位的相对致钝作用最大,氯次之,溴再次之,碘又次之。这样,在卤代苯的亲电取代反应中,碘代苯的邻位产物应该最多,氟代苯的邻位产物应该最少。
已经证明,通过只从分子模槽对位射进的封闭的基质分子,能发生专位的对位取代。
2.2.3 超过一个取代基的苯环定位
在许多情况下已在环上的基团是互相加强的,此时往往可能预测产物的比例。然而,当这些基团定位彼此相反时,预测产物比例就非常困难了。尽管如此,还是有一些规律的:
(1)如果一个强活化基团与较弱的基团或与钝化的基团发生争夺时,前者是控制的。
(2)所有其它条件相同,进入的第三个基团,至少可能在两个基团之间成间位关系。这种效应与位阻有关。
(3)当间位基团与邻对位基团成间位时,进入的基团主要是进入间位基团的邻位,不是在对位。这叫邻位效应。
2.2.4 其它环系定位
稠环系的位置是不等的,甚至在未取代的烃上也常有一个顶好的定位。杂环化合物的位置也不等,原理类似。当稠环系有取代基时,结合上述原理,常可作出成功的预测。在更迭烃中,在给定的位置的反应性与它的自由价成正比。
2.2.5 基质反应性的定量处理
通常,由于有几个可以离去的氢在环上的事实,因此芳香取代的定量速率研究非常复杂。因而测定各个反应的总速率并不能反映反应的全貌,这时需要的是每个位置的速率比。这样我们可以把一定基团和一定反应的分速率因子,规定未在一个位置上相对与苯的一个位置取代的速率。
如果假定取代基的效应是可以加合的,就可以用分速率因子来预测在二元或多元取代苯上形成的产品异构体的比例。
然而,取代基的影响是比较复杂的,空间效应,取代基的共轭效应都在影响进入基团的分布。因而,简单的应用分速率因子的加合来估计进入基团的分布,会与实际情况不相一致的。
另外一种办法就是用只有一个离去基团的作用物进行比较以避免由于作用物里离去基团的竞争引起的问题。使用的作用物的离去基团不是氢而是一个其它的基团就可以很容易的达到这个目的。通过这种方法,可以测定反应的总的速率比例。
2.2.6 对亲电试剂的反应性的定量处理,选择性关系
亲电试剂的反应能力并不是完全等同的。对此进行处理的最明显的方法是用Hammett方程:
![]()
但是,Hammett方程用于吸电子基团是相当成功的,用于给电子基团则失败了。若用Brown σ+值来修正σ值,则可成功解释给电子基团。但这种方法对邻位取代则不能应用。
Hammett方程的修改,是Brown根据反应试剂的反应性随选择性相反变化的原理提出来的,叫选择性关系。
Brown规定反应的选择性Sf为:
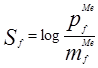
其中,pf和mf分别为对位和间位的分速率因子。
如果把Hammett-Brownσ+ρ关系和logSf及logpfMe之间以及logSf及logmfMe之间的线性关系合并在一起,则得到下列公式:
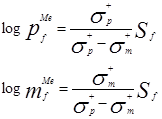
Sf与ρ之间的关系为:
![]()
这些公式和由甲苯的取代反应得到的大量的实验资料是相符合的。同时,这样的处理对于其它一些不太容易极化的取代极也是适用的,但对于比较容易极化的基团,则这种关系有时适用,有时不适应。这种关系同样对很强的亲电试剂也不适用。




